2017 HKDSE
PIA
1.
|
2.
|
3.
|
4.
|
5.
|
6.
|
||||||
7.
|
8.
|
9.
|
10.
|
11.
|
12.
|
||||||
13.
|
14.
|
15.
|
16.
|
17.
|
18.
|
||||||
19.
|
20.
|
21.
|
22.
|
23.
|
24.
|
||||||
25.
|
26.
|
27.
|
28.
|
29.
|
30.
|
||||||
31.
|
32.
|
33.
|
34.
|
35.
|
36.
|
PIB
1. (a) 離域電子/電子海與金屬離子/鋇離子/Ba2+間 (1)
的金屬鍵/靜電引力 (1)
(不接受:巨大金屬鍵)
|
|
(不接受: 自由電子 / 電子 / 最外層電子 )
(亦接受附有正確標示的圖形)
(圖形: (1) 鋇離子必須標示為“Ba2+” 或 “2+”。
(2) 必須清楚表示在金屬離子間的電子海或離域電子。
(3) 必須清楚表示在金屬離子及電子海/離域電子之間的金屬鍵或靜電 引力。)
|
|
(b)(i) 與空氣相比,該氣體(氨)的密度較低。(1)
(必須從密度方面作答。 不接受: 該氣體較空氣輕。) (不接受錯誤的氣體描述如:銨,NH4,NH4+,HCl
等。)
(b)(ii) 該氣體(氨)(在水中)溶解。 (1)
(接受:該氣體會被水吸收 / 該氣體會與水反應。)
(不接受:該氣體微溶於水。)
(c)(i) 生成白色固體 /生成白色沉澱物 / 釋出熱 (1)
(接受: 生成乳濁混合物 / 生成混濁混合物 / 生成白色懸浮液。/ 升溫 / 生成白色 ppt)
(c)(ii)(1)
當加入 H2SO4(aq) 後,生成 BaSO4(s) (及H2O(l)),這樣混合物內游動離子的濃度/數量減少了 / [Ba2+]
及 [OH-] 減少了。 (1)
(c)(ii)(2)
過量的 H+(aq) 及 SO42-(aq) 離子被加進溶液。/ 溶液中的 H+(aq) 及SO42-(aq) 濃度/數量/數目增加。/ 當H2SO4過量時,溶液中的 (游動) 離子濃度/數量/數目增加。
(接受在答案中只提及 H+ 或 SO42-。)
2. (a) 銅並不及鐵般那樣容易被氧化/侵蝕。 (1)
(接受:鐵會與水/氧氣/空氣/酸反應,但銅不會。)
(不接受:鐵會生銹但銅不會。 / 銅不及鐵般那樣容易生銹。)
與鐵相比,銅失去電子的趨勢較低。/ 銅在電化序/金屬活性序中的位置較鐵低。/ 與鐵相比,銅是較不活潑。 (1)
(b) (i) 降低焊接物料的熔點。
(不接受:鉛的熔點低)
(ii) 鉛 /鉛的化合物是有毒的。(1)
(接受: 鉛會損害中樞神經系統 / 鉛對中樞神經系統有害 (或其他器官)。)
(不接受有害的)
(c) (1.0 × 10-8 ×1000) ÷ 207.2 (1)
= 4.83 × 10-8 (mol
dm-3) (1)
(接受 4.8, 4.83,
4.826。不接受 4.830)
(接受沒有單位的答案,但不接受錯誤單位的答案。)
3. (a) 丙烯分子帶 C=C 鍵, 但丙烷分子則否。 (1)
(接受:碳雙鍵。)
(不接受: 丙烯是不飽和的而丙烷是飽和的。/ 丙烯是一烯烴而丙烷是一烷烴。)
(b) HO2C(CH2)4CO2H
是一雙官能分子 / 有著兩個 –CO2H
基團 / 有著兩個基團 (與–NH2 基團反應) (1)
相反 CH3(CH2)4CO2H
是一單官能分子 / 只有一個 –CO2H
基團 / 只有一個基團(與 –NH2 基團反應)。 (1)
每一 HO2C(CH2)4CO2H
分子能夠與兩個 H2N(CH2)6NH2
分子反應而形成鏈狀,相反 CH3(CH2)4CO2H
分子則只能與一個 H2N(CH2)6NH2
分子反應而不能形成鏈狀。 (1)
(c) H2O 中的 O 原子有孤電子對。(1)
H+ 在其最外層沒有電子。 (1)
H2O 中的 O 原子與 H+ 以共享電子對形成配位共價鍵。 (1)
4. (a)(i) A: OH-(aq) 離子(優先) 放電生成(無色)氣體( 氧) 。 (1)
(接受沒有提及氧。不接受提及錯誤的氣體。)
(不接受: OH- (aq) 離子優先放電生成氧。)
(a)(ii) B:H+ (aq) 離子(優先)放電生成(無色)氣體( 氫) 。 (1)
(接受沒有提及氫。不接受提及錯誤的氣體。)
(不接受: H+ (aq) 離子優先放電生成氫。)
( 當H+離子被消耗時,) [OH- (aq)] >
[H+(aq)],故令溶液變為粉紅色。
(接受粉紅,紅,紫,紫紅,洋紅)
(接受只提及OH-的濃度 / 量 / 摩爾數增加 / 累積較多的OH- (aq),而沒有提及H+。)
(b) 2H2O→2H2
+ O2 (1)
(不要求物態符號。若所給的物態符號有錯,答案將視為錯誤。)
(c)(i) A:沒有改變。OH- (aq) 離子(仍然優先) 放電生成無色氣體( 氧) 。(1)
(c)(ii) B:沒有改變。H+ (aq) 離子是唯一的陽離子,它放電生成無色氣體( 氫) 。(1)
(接受:因著溶液中H+的濃度增加,無色的汽泡以較快的速率生成。)
儘管 [H+
(aq)] 下降 / 因著H+是過量的,溶液仍是酸性,所以它的顏色沒有改變 / 不會轉變成粉紅色。(1)
(接受:因著H+放電,接近電極表面的溶液會變成粉紅色,但因在溶液中有過量的H+,因此整體上的顏色轉變會遠較不明顯 / 溶液仍然是無色。)
5.
在 H2 分子之間以及在 F2 分子之間皆是靠弱的范德華力吸引。(1)
因為 F2
的大小較 H2 的大小為大,所以在 F2 間的范德華力強於在 H2 間的范德華力。(1)
(接受: 相比 H2分子,F2 分子有較多的電子。
不接受: F2
的分子質量較 H2 的為高。)
在 HF 分子之間存在氫鍵,且氫鍵較范德華力強。(1)
6. (a) 氧化性及腐蝕性 (1)
(b) (i) 濃硫酸與 NaOH(aq) 的反應高度放熱。/ 濃NaOH有腐蝕性。/ 避免重覆填充滴定管。/ 使用較少量化學品。 (1)
(不接受「濃酸將會濺出」但沒有提及高度放熱等答案。)
(b) (ii) 紅色變為橙色。 (1)
(不接受「紅色變黃色」。 )
(b) (iii)所用 NaOH 的摩爾數 = 0.189 ×
22.20 × 10– 3 = 4.20 × 10– 3 (1)
濃硫酸的濃度 = 4.20 × 10– 3 ÷ (2 × 25
× 10– 3 ) × (1000 ÷ 5) (1)
= 16.8 (mol dm– 3 ) (1)
正確單位。
(接受16.76、16.78、16.783、16.784、16.80 (mol dm–
3 )。
不接受16.7832 mol
dm– 3。)
(c) 銅溶解。/ 液體變為藍色。/ 無色/帶窒息氣味的氣體(氣泡)釋出。 (1)
Cu + 2H2SO4 → CuSO4
+ 2H2O + SO2 (接受離子方程式)(1)
或 銅溶解。/ 液體變黑 / 生成黑色固體/沉澱物。 / 無色/帶窒息氣味的氣體(氣泡)釋出。
Cu + H2SO4
→ CuO + H2O + SO2 (接受離子方程式)
(不要求物態符號。)
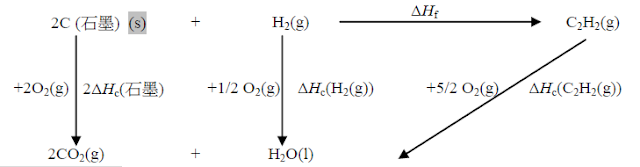
7. (a) 碳與氫的反應不會只生成乙炔 / 會有副作用。/ 會有副產物。 / 在室溫條件下碳與氫氣不會起反應。 (1)
(b) 一化學反應的總焓變是與由起始態至最終態所經歷的途徑無關。 (1)
(c) (i)
(2)
(正確的物態符號)
(c) (ii)
(1) 298K / 25℃
及
1 atm / 101 kPa / 101325 Nm- 2 (1)
(2) ΔHf θ[C2H2
(g)] = 2×(–394) +
(–286) – (–1300) (1)
= +226 kJ mol– 1 (1)
(正確單位。要顯示正號。)
8. (a) 2C8 H18 + 25O2 → 16CO2 +
18H2O (1)
(不要求物態符號。反應系數應為整數。)
(b)
(1)
(接受有顯示內層電子繪圖的答案。)
(c) 「贊成」: 利用碳捕獲技術,把發電廠所產生的CO2收集,減少CO2排放到大氣中。 / 與電油驅動汽車比較,發電廠有較高能源效益,可減少CO2
排放。 / 使用如太陽能等可再生能源驅動電動車輛,可減少CO2排放。 (1)
「反對」:驅動汽車的電主要是由燃燒化石燃料而產生的,故仍有CO2排放到大氣中 。/ 生產電動車輛的電池組過程會增加CO2排放。 (1)
(d) 空氣或氧不足 / 電油的量過多 (1)
(e) (i) 催化轉化器 † / 催化轉換器
(1)
(e) (ii) 微粒 / 懸浮粒子 / 二氧化硫 /
PM (1)
(不接二氧化氮。)
9. 酸化 K2 Cr2O7
(aq) 測試:只有HOCH2CH2CH2OH會令橙色變為綠色。/ 其餘三個液體得出陰性結果。 (1)
或
酸化/中性KMnO4 (aq) 測試:只有HOCH2CH2CH2OH或CH2 =CHCO2 H 會令紫色變為無色/棕色。 / 其餘兩個液體得出陰性結果。
Br2 (在有機溶劑中) 測試:只有CH2
=CHCO2H會令棕/橙色變為無色。/ 其餘三個液體得出陰性結果。 (1)
或
Br2 (aq) 測試:只有CH2 =CHCO2H會令棕/ 橙/ 黃色變為無色。/ 其餘三個液體得出陰性結果。
或
酸化/中性KMnO4 (aq)測試:只有HOCH2CH2CH2OH或CH2 =CHCO2 H會令紫色變為無色/棕色。 / 其餘兩個液體得出陰性結果。
把每一液體先加進水中,(1)
Mg / Zn測試:只有CH3CH2CO2H或CH2 =CHCO2H起反應得到無色氣體(氣泡)/ 氫氣 / H2 (g)。/ 其餘兩個液體得出陰性結果。 (1)
或
CO3 2 - / HCO3
- 測試:只有CH3CH2CO2
H或CH2 =CHCO2 H起反應得到無色氣體(氣泡)/ 二氧化碳 / CO2 (g)。 / 其餘兩個液體得出陰性結果。
或
酯化作用:在濃H2
SO4 / 加熱條件下:只有CH3CH2CO2H或CH2 =CHCO2 H 與烷醇(如乙醇)起反應得香味。 / 其餘兩個液體得出陰性結果。
或
中 和 作 用 : 鹼 (如 NaOH(aq) ) / 加 水 和 鹽基: 只有CH3CH2CO2 H 或CH2
=CHCO2 H起反應放熱。 /
其餘兩個液體得出陰性結果。
在以上三項化學測試中,CH3CO2CH3均呈陰性結果。 (1)
(不接受使用嗅覺、pH/石蕊試紙、指示劑、水溶解度等方法。)
(接受其他如使用PCl3
等測試方法。)
傳意分數
(化學知識 = 0 至 2 ,傳意分數 = 0;化學知識 = 3 或 4,傳意分數 = 0 或 1;若答案不完整或難以理解或沒有分辨意思,傳意分數=0)
10. (a) (60÷24000) × 2 = 0.005 y (1)
y = 1.0 mol dm-3 (1)
(接受沒有單位的答案,但不接受錯誤單位的答案。)
(最多接受小數點後列出三個數字)
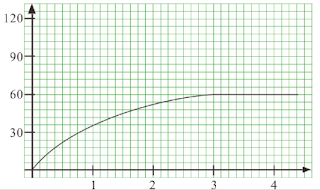
(b) 曲線從點 (0,0) 開始,其斜率逐漸減少,直到第三分鐘時變成一水平線。 (1) 所得到氣體的總體積是 60 cm3
。 (1)
(若曲線由兩段直線折線組成,只給1分予「所得到氣體的總體積是60 cm3」。)
(c) 會收集到 60 cm3
的氣體,這是因為在這兩實驗中,H2O2的摩爾數均相同。 (1)
/ 會收集到 60 cm3 的氣體,這是因為提高溫度只會增加反應速率( ,而不會影響所生成的產物的量) 。
(不接受意思含糊的答案,如 “同等分量的 H2O2”)
(d) 跟隨體系( 總)壓強 / 質量的變化。 (1)
(接受:使用壓強計/ 電子天平來監測體系。)
11. (a) Kc
= [H+(aq)] [A-(aq)] / [HA(aq)] (1)
其中 HA 代表 4-硝基酚及 A-代表4-硝基酚鹽離子。
(接受在表達式中沒有給予物態符號。)
(b) 在溶液中,2.4 = –log [H+(aq)] (1)
H+ (aq)] = 4.0 × 10-3 mol dm-3 (接受 3.98 × 10-3
~4.0 × 10-3 mol dm3 (1)
(接受沒有單位的答案。 不接受錯誤單位。)
8.0 x 108 = 4.0 × 103 [A-
(aq)] / [HA(aq)]
[HA(aq)] / [A- (aq)] = 50000 (1)
(接受 49750 ~ 50000, 4.975 × 104
~ 5 × 104)
(亦接受 [A- (aq)] / [HA(aq)] = 1/ 50000 或 2 × 105
~2.01 × 105)
(c) 當H+(aq) 被 NaOH(aq) 消耗時,平衡位置遂向右移。 (1)
(亦接受: 逆向反應的速率減低 / HA 會分解以補充失去的 H+,生成更多的A-。)
HA 是無色而A-是黃色的。[A-]的增加使溶液由無色變成黃色
/黃 / 顏色變深。 (1)
(d) 指示劑 / 用來找出酸-鹼滴定終點 (1)
12. (a) CH3CH2CH(Br)CH2CH3
/ CH3CH2CHBrCH2CH3 (1)
(b) (i) B 經與 HBr 反應後,它的OH 基團轉化為在 C中的Br基團,及因為它不具旋光性,所以並沒有手性碳。 (1)
(接受:B 與 HBr 反應後得出在C中的Br基團,因此B是醇。)
故 B 的結構是 CH3CH2CH(OH)CH2CH3 / CH3CH2CHOHCH2CH3。 (1)
(b) (ii) 取代 († )
(c) (i) A比B少了兩個 氫原子,A有C = C (或C = O )雙鍵。A具有旋光性,即是它有一個手性碳。(1)
A的結構是 CH2=CHCH(OH)CH2CH3
/ CH2=CHCHOHCH2CH3。
(c) (ii) H2 / Pd (加熱) 或 H2 / Pt (加熱) 或 H2/Ni (加熱)
13.
(3)
(中間體 : 1 分;每個步驟的試劑 : 1 分)
(步驟一:
1. 接受的試劑: OH-,
NaOH 或 NaOH(aq);不接受 NaOH(s) 或固體NaOH。
2. 接受的試劑: H+
/ H2SO4 / H2SO4(aq), 或 HCl /
HCl(aq)。
3. 在加鹼水解或加酸水解中,必須要 ”加熱”。
4. 接受 COO-Na+
為正確中間體 (需要配合正確的對應試劑。)
5. 不接受 O―Na 為中間體。)
(步驟二:
1. 若然中間體不正確,但仍有–COOH 基團,及在路線中顯示一正確的還原反應,若試劑正確,試劑給一分。
2. 若然步驟一是加鹼水解,及沒有酸化步驟,接受 –COO-Na+為中間體進行 LiAlH4
還原反應。
3. 不接受在酸性介質中使用 LiAlH4
。
4. 須要在LiAlH4還原後附有酸化步驟。須要清楚表明LiAlH4還原及酸化是兩個步驟。
5. 在LiAlH4一步中接受沒有寫上”乾醚” 。)
14. 2MnO4-(aq) + 5C2O42-(aq) + 16H+(aq) → 2Mn2+(aq) + 10CO2(g)
+ 8H2O(l)
(不要求物態符號) (忽略錯誤的物態符號)
錳展示不同氧化數,在反應中錳的氧化數由在 MnO4-中的 +7 轉變為在 Mn2+
中的 +2。 (1)
錳在水溶液中生成有顏色的離子。MnO4-
(aq) 離子呈紫色 / Mn2+(aq) 呈淺粉紅色。 (1)
從坐標圖所顯示,當生成 Mn2+
離子時/ 當反應在進行時,反應速率增加。(1)
(須要提及 Mn2+
。不接受提及其他不正確物種如 MnO4-。)
錳有催化的性質。Mn2+ 離子作為該反應的催化劑。(1)
傳意分數
(化學知識 = 0 至 2 ,傳意分數 = 0
化學知識 = 3 至 5,傳意分數 = 0 或 1
若答案不完整或難以理解,傳意分數=0)
PII








沒有留言:
張貼留言